Al (OH) 3 Kết Tủa Màu Gì? Ứng Dụng Al (OH) 3 Trong Đời Sống

Xem nhanh
Al (OH) 3 kết tủa màu gì? và tính chất của Al (OH) 3 là gì? Hãy cùng khám phá chất này qua bài viết dưới đây nhé.
Al (OH) 3 kết tủa màu gì? Định nghĩa và tính chất của Al(OH)3

Định nghĩa
– Al(OH)3, còn được gọi là nhôm hydroxit, được tìm thấy trong tự nhiên dưới dạng khoáng chất gibbsite (còn được gọi là hydracgilite) và ba trong số các dạng đa hình hiếm hơn của nó: doyleite, bayerite, doyleite và nordstranda.
– Công thức phân tử: Al(OH)3
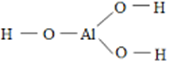
– Công thức được xây dựng như sau:
Tính chất vật lý
Al(OH)3 có màu gì ? Là chất rắn màu trắng, không tan trong nước.
Tính chất hóa học

– Ít bền nhiệt: Khi đun nóng với Al(OH)3, nó phân hủy thành Al2O3.
PTHH: 2Al(OH)3 →Al2O3 + 3H2O
– Là hiđroxit lưỡng tính:
+ Phản ứng với axit mạnh:
PTHH: Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Tác dụng với dung dịch kiềm mạnh:
PTHH: Al(OH)3 + KOH → KAlO3 + 2H3O
PTHH: Al(OH)3 + KOH → K[Al(OH)4]
Cách điều chế nhôm hydroxit
– Kết tủa ion Al3+:
PTHH: Al3+ + 3OH- (vừa đủ) → Al(OH)3
PTHH: Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
PTHH: 3NaOH + AlCl3 → 3NaCl + Al(OH)3
– Lượng mưa AlO2-:
PTHH: AlO2- + CO2 + 2H2O → Al(OH)3 + HCO3-
PTHH: AlO2- + H+ (vừa đủ) + H2O → Al(OH)3
PTHH: NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
Ứng dụng của Al (OH) 3 trong đời sống
Phần lớn nhôm hydroxit được sử dụng làm nguyên liệu thô để sản xuất các hợp chất nhôm khác: polyalumin clorua, nhôm sunfat, nhôm clorua, nhôm hoạt tính, zeolit, natri aluminat, nhôm nitrat.
Nhôm mới kết tủa có dạng gel hydroxit, đây là cơ sở để ứng dụng muối nhôm làm chất kết tủa trong xử lý nước, loại gel này kết tinh theo thời gian, gel d Nhôm hydroxit có thể khử được bằng nước (ví dụ: sử dụng nước có thể trộn lẫn với các dung môi không chứa nước như ethanol) để tạo thành bột nhôm hydroxit vô định hình, dễ hòa tan trong axit.

Bột nhôm hydroxit khi nung đến nhiệt độ cao trong điều kiện được kiểm soát cẩn thận được gọi là alumina hoạt tính và được dùng làm chất hút ẩm, làm chất hấp phụ trong lọc khí, làm chất xúc tác Claus hỗ trợ lọc nước và làm chất hấp phụ cho các chất xúc tác trong sản xuất. polyetylen được sản xuất bằng quy trình Scl Airtech.
Nhôm hydroxit cũng được sử dụng làm chất độn chống cháy cho các ứng dụng polyme, tương tự như magie hydroxit và hỗn hợp Huntite và hydromagnesite.
Một số hợp chất nhôm khác
Nhôm oxit – Al2O3
Tính chất vật lý
– Là chất rắn màu trắng, không tan và không hoạt động với nước, rất ổn định, nóng chảy ở 20500C.
– Tồn tại ở dạng khan (emerite, ruby (trộn với Cr2O3), corundum, sapphire (trộn với TiO2 và Fe3O4) hoặc ở dạng ngậm nước (boxite)).
Tính chất hóa học
– Sự bền vững :
Al2O3 không bị khử bởi H2 và CO ở nhiệt độ cao; Al2O3 phản ứng với C không tạo thành kim loại Al mà tạo thành Al4C3:
Al2O3 + 9C → Al4C3 + 6CO (> 20000C)
– Lưỡng tính:
+ Al2O3 là oxit bazơ khi tác dụng với axit mạnh → muối + H2O.
PTHH: Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Al2O3 là oxit axit khi phản ứng với dung dịch bazơ (mạnh) → muối + H2O.
PTHH: Al2O3 + 2NaOH → NaAlO2 + H2O
TỐT
PTHH: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
PTHH: Al2O3 + 2OH- → 2AlO2- + H2O
Điều chế:
Nhiệt phân Al(OH)3:
2Al(OH)3 → Al2O3 + 3H2O
Muối aluminat AlO2-
– Các muối aluminat NaAlO2, KAlO2, Ca(AlO2)2 và Ba(AlO2)2 đều là dung dịch bazơ với môi trường bazơ.
AlO2- + 3H2O ↔ Al(OH)3 + 3OH-
– Phản ứng với dung dịch axit:
AlO2- + H+ + H2O → Al(OH)3
Al(OH)3 + 3H+ → Al3+ + 3H2O
Chú ý:
+ Nếu nH+ < 4nAlO2- → có kết tủa.
+ Nếu nH+ ≥ 4nAlO2- thì không có kết tủa.
Ngoài ra, phương pháp phản ứng cũng ảnh hưởng phần nào đến hiện tượng quan sát được.
Hy vọng bài viết trên sẽ giúp học sinh biết kết tủa Al(OH)3 có màu gì và nó có ứng dụng gì? Chúc các em luôn đạt kết quả tốt trong học tập và đạt được nhiều thành tích cao trong học tập và cuộc sống.



